الكيمياء واختلاف المادة و كيفية تفاعل الذرات لتكوين الجزيئات وكيفية تفاعل الجزيئات مع بعضها البعض كل هذا مرتبط بدراسه العلم وتفاعلات المادة وعلاقتها بالطاقة كل ماتريد معرفة عن الكيمياء في موقع ويكي العربي فتابعونا .
قدّم دالتون نظريته المتعلقة ببنية المادة عام 1803، فأسهمت نظريته هذه في إجراء مزيد من الأبحاث لإيجاد الكتل النسبية لذرات العناصر. فكان لهذه الأبحاث أثر بالغ الأهمية في مستقبل الكيمياء وفي حقول المعرفة المتعلقة بها كافة؛ للحاجة إلى طريقة عملية لوزن عيّنات العناصر التي تحوي ذرات العناصر بالنسب اللازمة لاصطناع المركبات.
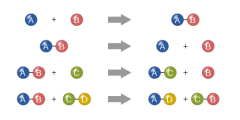
فإذا كان المطلوب، على سبيل المثال ، كمية من مركب كبريت الحديد، FeS ,(II)، فذرات الحديد في هذا المركب تتحد مع ذرات الكبريت بنسبة 1 إلى 1. فكل ذرة من الحديد تتحد مع ذرة واحدة من الكبريت. وعملياً، تكمن الصعوبة في أن الذرات صغيرة جداً بحيث لايمكن عدّها كما تعدّ الأشياء الكبيرة. وإن النسبة ذرة واحدة إلى ذرة واحدة هي النسبة المهمة بغض النظر عن وزن ذرة الحديد أو وزن ذرة الكبريت.
فكل ما يلزم من أجل تعيين الأوزان الذرية هو انتخاب عنصر يعد أساساً لمقارنة أوزان باقي العناصر بالنسبة إليه. وهذا الانتخاب اختياري. فيمكن على سبيل المثال، استعمال الكبريت لهذا الغرض. وتم الاتفاق، عالمياً على اتخاذ نظير الكربون 21 أي عدده الكتلي 12 المرجع العياري. وبهذا الاختيار يكون الوزن النسبي لأخف العناصر جميعاً، الهدروجين، مساوياً 1 تقريباً.
وإن الكتلة الوسطية لذرات العنصر الموجودة في الطبيعة مقاسة بالنسبة إلى المرجع الكربون 12 تدعى الوزن الذري للعنصر.
وبإجراء قياسات غير مباشرة تبيّن أن كتلة ذرة واحدة من الكربون 12 تساوي 1.9926786×10-23 غراماً. وإن 1/12 من هذه الكتلة يدعى واحدة الكتلة الذرية (اختصاراً و.ك. ذ)؛ أي:
و. ك. ذ = 1.6605665×10-24 غرام
وتسمح هذه الكمية باستعمال واحدة الكتل الذرية واحدةً لقياس الأوزان الذرية. فعلى سبيل المثال الوزن الذري لنظير الكربون 12 يساوي تماماً 12 و.ك. ذ.
وإن الاستنتاج الرئيسي من دراسة الأوزان الذرية هو أنه إذا أخذت عينتان من أي عنصرين بحيث تكون نسبة وزنيهما (بالغرام) مساوية إلى نسبة وزنيهما الذريين، فتكون نسبة عدد ذرات أحد العنصرين إلى عدد ذرات الآخر تساوي 1/1. وإذا كان المطلوب نسبة بين عدد ذرات الأول إلى الثاني مختلفة عن الواحد، فيمكن تعديل أمثال نسبة الوزن الذري للأول إلى الوزن الذري للثاني.