الكيمياء واختلاف المادة و كيفية تفاعل الذرات لتكوين الجزيئات وكيفية تفاعل الجزيئات مع بعضها البعض كل هذا مرتبط بدراسه العلم وتفاعلات المادة وعلاقتها بالطاقة كل ماتريد معرفة عن الكيمياء في موقع ويكي العربي فتابعونا .
المركبات الكيميائية
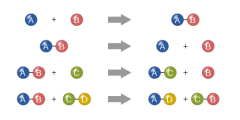
فيدعى مجموع الأوزان الذرية للذرات الموجودة في الصيغة الكيميائية وزن صيغة المركب، ويسمى أيضاً الوزن الجزيئي. وإن «وزن صيغة المركب» أشمل من «الوزن الجزيئي»؛ لأنه يمكن استعمال المصطلح الأول في حالة المركبات أو العناصر، بغض النظر عن أنواع الجسيمات المكوِّنة له. فيمكن القول إن وزن صيغة الصوديوم هو 22.98977، وهو يساوي الوزن الذري في الوقت ذاته. وإن وزناً من المادة يساوي الوزن الجزيئي مقدراً بالغرام يدعى الوزن الجزيئي الغرامي أو المول.
وعدد وحدات الصيغة في المول كبير جداً يصعب تخيله، فالمول الواحد من المادة النقية يحوي 6.02×2310 وحدة صيغة ويدعى هذا العدد عدد أفوغدرو[ر]. وهو يدل على مدى صغر الذرات والجزيئات. وتأتي أهمية عدد أفوغدرو من أن العدد نفسه من المولات يحوي العدد نفسه من وحدات الصيغة. فـ 10.5 مول من السكر، على سبيل المثال، تحوي عدداً من وحدات الصيغة (جزيئات) مساوياً 10.5 مول من الحديد (وحدات صيغته هي الذرات).
لمفهوم المول أهمية كبيرة ؛لأنه يساعد على التفكير بالصيغ على مستويين في الوقت نفسه، مستوى ذرة/جزيء من جهة ومستوى الكميات العملية المستعملة من المختبر من جهة أخرى، فاثنا عشر جزيئاً من H2O تحوي 2×12 ذرة من الهدروجين واثني عشر جزيئاً من الأكسجين O. وإن الأعداد هي نفسها سواء في حالة الجزيئات والذرات أو في حالة المولات.
الذوبان ونقطة الغليان
تبلغ درجة الانصهار أدنى حد لها في الغازات النادرة، وتبلغ أعلى حد لها في الفصيلة IVA (أو 14) بالنسبة للعناصر الخفيفة، وفي الفصيلة VIB (أو 6) بالنسبة للعناصر الثقيلة. ومما يلاحظ أيضاً أن عناصر الفصيلة الواحدة تشغل مواضع متشابهة على الأجزاء الصاعدة أو الهابطة من المنحني.
ومن المفيد القول إن ارتفاع درجة حرارة انصهار الكربون (د. أ > 3500 ْس) يعود إلى قوة الرابطة المشتركة بين ذراته، كما يعود الانخفاض المفاجئ في درجة انصهار الآزوت (-120 ْس) عن العنصر الذي قبله وهو الكربون إلى ضعف الروابط التي تربط جزيئات N2 فيما بينها.
=الكثافات
تتغير كثافة العناصر وهي في حالتها الصلبة بصورة دورية مع أعدادها الذرية. تزداد الكثافة من عنصر إلى الذي يليه في الدور الواحد بصورة منتظمة، فتبلغ أعلى قيمة لها في وسط الدور، كما أنها، بصورة عامة، تزداد في الفصيلة الواحدة من الأعلى إلى الأسفل.
التركيب البلوري
يعد نصف قطر الذرة أو الشاردة (الأيون)، عادة، المسافة بين النواة والطبقة الخارجية للإلكترونات. ومن الواضح أنه يستحيل عزل ذرة أو شاردة بمفردها لتعيين نصف قطرها، خاصة أن حجمها أو نصف قطرها يتأثر بتجمعها مع جسيمات أخرى. فقيمة نصف القطر في المركّب تتوقَّف على العوامل الآتية: نوعية الرابطة شاردية كانت أو معدنية أو مشتركة، وهل هي أحادية أم مضاعفة أو ثلاثية، وهي تتوقف أيضاً على عدد أكسدة الذرة، وعلى العدد التساندي للذرة؛ أي عدد الذرات المرتبطة مباشرة بالذرة في البلورة وعلى قوى التدافع بين الذرات غير المرتبطة مباشرة معها بعضها مع بعض.
نصف القطر الذري يتناقص من اليسار إلى اليمين بالدور الواحد، ويعزى التناقص في الحجم إلى ازدياد العدد الذري للعناصر. فعندما يزداد العدد الذري تزداد شحنة النواة ويزداد جذبها للإلكترونات، وهذا يؤدي إلى نقصان حجم الذرة. ولهذا النقصان في الحجم تأثير في الخواص المعدنية للذرات. فكلما كبر حجم الذرة بعدت إلكترونات التكافؤ عن النواة وأصبحت إمكانية الذرة في التخلي عن هذه الإلكترونات أكبر، أي ازدادت الصفة المعدنية للذرة. يمكن أيضاً القول إنه إذا كان لذرتين الحجم الذري نفسه، كانت الذرة ذات العدد الذري الأكبر (شحنة نواتها أكبر) أكثر لامعدنية، وبتعبير آخر اللامعادن هي العناصر ذات الذرات الصغيرة والشحنات الكبيرة.